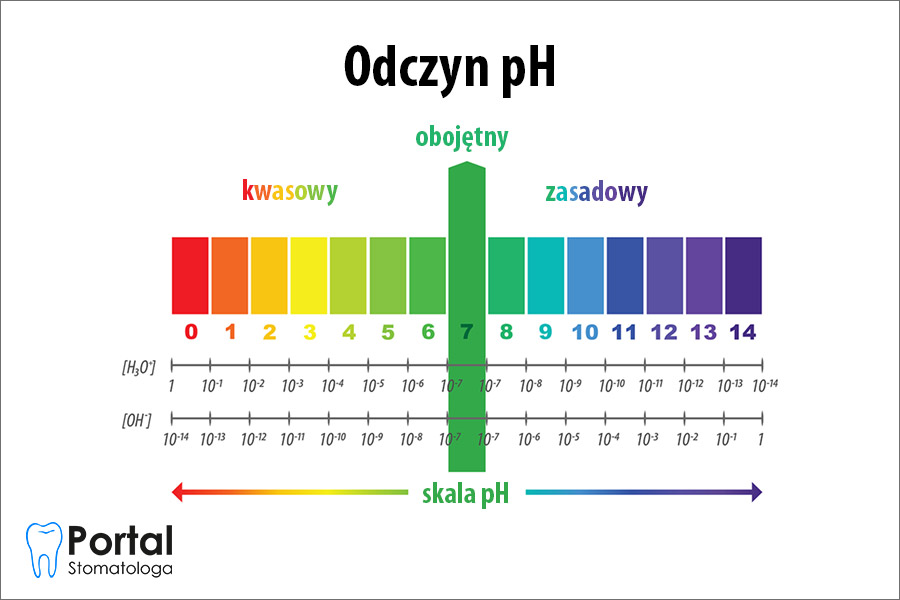
Odczyn pH jest parametrem ustalanym na bazie skali pH, czyli ilościowej skali kwasowości i zasadowości roztworów wodnych związków chemicznych. Zgodnie z nią roztwory o pH poniżej 7 są kwasowe, roztwory o pH powyżej 7 są zasadowe, natomiast te o pH = 7 są obojętne. Znajomość skali pH ma znaczenie również w medycynie – poszczególne odcinki organizmu (np. pochwa, skóra, układ pokarmowy na każdym swoim odcinku) mają swoje pH, które powinno być utrzymywane na właściwym poziomie.
Odczyn pH – charakterystyka
Odczyn pH to przejaw miary stopnia kwasowości danego roztworu wodnego. Zależy od wzajemnego stosunku stężeń jonów oksoniowych oraz wodorotlenkowych. Wymienia się 3 rodzaje odczynu pH:
- odczyn zasadowy: pH > 7;
- odczyn kwasowy: pH < 7;
- odczyn obojętny: pH = 7.
Odczyn to cecha roztworu zależna od stężenia jonów wodorowych. Jeśli więc w danym roztworze stężenie jonów wodorowych jest wyższe niż stężenie jonów wodorotlenkowych, taki roztwór wykazuje odczyn kwaśny. Można podsumować, że odczyn pH jest cechą roztworu elektrolitu zależną od wzajemnego stosunku stężeń jonów H3O+ i OH-.
Pomiar odczynu pH
Pomiar odczynu pH jest możliwy przy zastosowaniu odpowiednich wskaźników, do których należą przede wszystkim:
- fenoloftaleina – zmienia zabarwienie na malinowe w roztworach zasadowych;
- oranż metylowy – zmienia zabarwienie na czerwone w roztworach kwaśnych;
- uniwersalny papierek wskaźnikowy – staje się czerwony w roztworach kwaśnych, a zielononiebieski w roztworach zasadowych.
Określenie odczynu pH ma charakter jakościowy, nie informuje natomiast o tym, jakie dokładnie jest stężenie jonów wodorowych i jakie konkretnie pH występuje w tym roztworze. Wykładnikiem stężenia jonów wodorowych jest skala pH, składająca się z wartości liczbowych od 0 do 14. Odpowiada stężeniu jonów wodorowych w roztworze. Wartości bliskie 0 oznaczają maksymalną kwasowość roztworu, natomiast wartości w pobliżu 14 odnoszą się do maksymalnej zasadowości roztworu.
Odczyn pH – przykłady
Aby lepiej zobrazować sobie odczyn pH w życiu codziennym i otaczającym nas świecie, warto przytoczyć kilka przykładów dla poszczególnej wartości skali pH. Takie przykłady mogą być następujące:
- pH 0 – kwas akumulatorowy;
- pH 2 – ocet;
- pH 3,5 – oranżada;
- pH 5 – kawa;
- pH 6 – jajka;
- pH 7 – woda z kranu;
- pH 7,4 – ludzka krew;
- pH 8 – woda morska;
- pH 9 – sałata;
- pH 9,5 – soda kuchenna;
- pH 10 – woda alkaliczna;
- pH 11 – roztwór amoniaku;
- pH 13,5 – wybielacze;
- pH 14 – udrażniacze do rur kanalizacyjnych.
Oszacowanie pH ma znaczenie również znaczenie celem monitorowania stanu ludzkiego zdrowia. Wszelkie zmiany pH, znacznie odbiegające od fizjologicznych, mogą świadczyć o infekcjach i chorobach, a więc wymagają leczenia. Dla przykładu środowisko kobiecej pochwy powinno pozostawać w granicach pH 3,6-4,5, natomiast powierzchnia skóry ma u zdrowych osób pH w granicach 4,7-5,6. Sytuacja idealna dla układu pokarmowego to poziom zakwaszenia żołądka na poziomie 1-2,5 w skali pH, przy jednoczesnym zachowaniu pH około 8,0 dla dwunastnicy. Umożliwia to sprawne i pełne trawienie pokarmów.
Polecane produkty:

|
Kwas hialuronowy bioalgi
Kwas hialuronowy bioalgi to naturalny produkt z fermentacji roślinnej, dzięki czemu biodostępność jest na bardzo wysokim poziomie. Kwas hialuronowy działa głównie na takie struktury jak włosy, skóra, oczy, stawy, dziąsła ... Zobacz więcej... |

|
Kolagen naturalny bioalgi
Kolagen do picia to naturalny produkt z opatentowaną formułą Peptiplus® hydrolizowanego kolagenu. Dzięki temu jest bardzo wysokiej wchłanialności. Wzmacnia zęby, kości, ... Zobacz więcej... |
Bibliografia
- Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa‐Bielsko‐Biała 2010.
- Atkins P. W., Chemia fizyczna, Warszawa 2001.