Amylaza (dokładniej: alfa-amylaza) jest ważnym enzymem znanym od ponad 150 lat. Odpowiada głównie za rozkładanie wiązań alfa-1,4-glikozydowych znajdujących się w cząsteczkach skrobi (węglowodanu złożonego). W praktyce amylaza nie jest jednym związkiem, lecz ich grupą, występującą zarówno w organizmach ludzi, jak i zwierząt, drobnoustrojów czy roślin.
Amylaza – charakterystyka
Amylaza jest enzymem powszechnie występującym w organizmie człowieka. Jego obecność wskazano w sokach trawiennych, ślinie, krwi i moczu, a w nieco mniejszych ilościach również w trzustce, śliniankach, nabłonku układu moczowego, mięśniach, nerkach, płucach, a nawet komórkach nowotworowych. Alfa-amylazy ludzkie kodowane są w chromosomie 1 przez 2 istotne geny: Amy1 (określa właściwości amylazy śliniankowej) oraz Amy2 (określa właściwości amylazy trzustkowej).
W biologii i fizjologii wyróżnia się 3 podstawowe rodzaje amylaz:
- alfa – występuje zarówno w organizmach zwierzęcych, jak i roślinnych. Jej pełna nazwa brzmi 4-glukanohydrolaza alfa-1,4-glukanu. Hydrolizuje wiązania w polisacharydach, w których jest 3 lub więcej reszt D-glukozy połączonych ze sobą wiązaniami alfa 1:4. Działa więc na skrobię, glikogen i inne pokrewne związki;
- beta – egzoamylaza występująca wyłącznie w organizmach roślinnych. Rozkłada wiązania alfa-1,4-glikozydowe odszczepiając maltozę od nieredukującego końca łańcucha substratu;
- gamma – oddziałuje zarówno na wiązania alfa-1,4-glikozydowe, jak i na alfa-1,6-glikozydowe, występując w organizmach zwierząt, ludzi oraz roślin. Odczepia glukozę od nieredukujących końców łańcuchów skrobi i glikogenu, a także produktów ich degradacji.
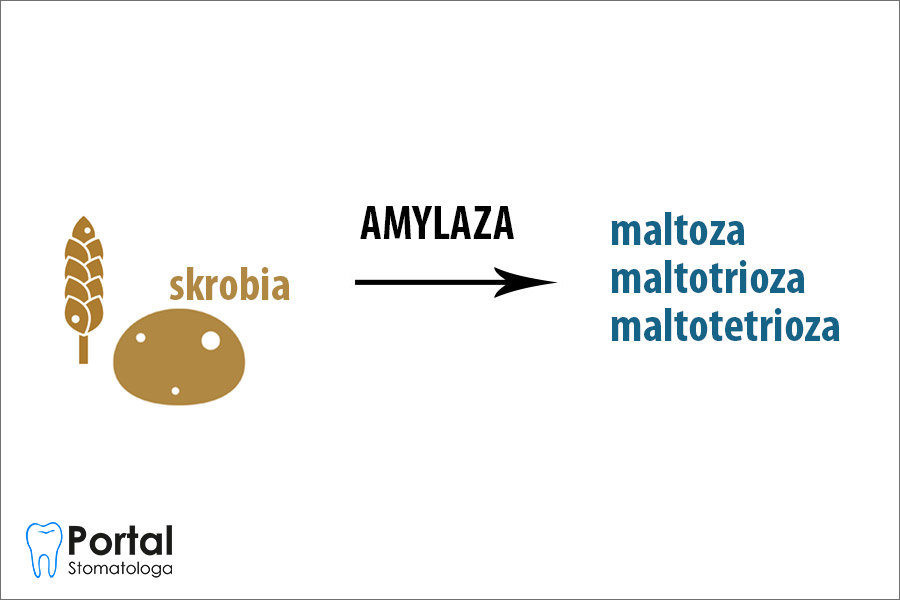
Końcowymi produktami hydrolizy skrobi i glikogenu przy udziale alfa-amylaz pochodzenia śliniankowego są maltoza, maltotrioza, maltotetrioza oraz oligasacharydy zawierające od 5 do 10 reszt glukozy. Z kolei amylaza trzustkowa daje końcowe produkty hydrolizy wprawdzie identyczne jak enzym śliniankowy, z tą różnicą, że 30% produktów stanowi glukoza. Należy wspomnieć, że alfa-amylazy śliniankowe wykazują wyższe powinowactwo do skrobi, trzustkowe zaś do glikogenu.
Amylaza – funkcje
Amylaza jest enzymem odpowiedzialnym za trawienie wielocukrów (węglowodanów), co rozpoczyna się już w jamie ustnej podczas przeżuwania kęsów pokarmowych. Trawienie skrobi zaczyna się w jamie ustnej, przy udziale alfa-amylazy ślinowej. Optymalne pH dla działania tego enzymu wynosi 6,7, w związku z czym jego aktywność ulega zahamowaniu w kontakcie z kwasem solnym, w momencie, w którym pokarm przedostaje się do żołądka. Dalsze trawienie wielocukrów odbywa się w jelicie cienkim pod wpływem alfa-amylazy ślinowej i trzustkowej. Oba te enzymy wywołują hydrolizę wiązań alfa 1:4, z kolei oszczędzają wiązania alfa 1:6, końcowe wiązania alfa 1:4 oraz wiązania alfa 1:4 w miejscach rozgałęzień łańcuchowych. Rezultatem działania amylazy jest rozbicie wielocukrów na oligocukry.
Amylazy w surowicy – badanie
Aktywność amylazy można oznaczać we krwi lub w moczu. Wskazaniem do takiego badania jest podejrzenie lub monitorowanie leczenia ostrego zapalenia trzustki, a objawami skłaniającymi do jego wykonania, są:
- nagły, silny ból w górnej i środkowej części brzucha;
- przyspieszone tętno;
- gorączka;
- zatrzymanie kału i gazów;
- wymioty.
Badanie jest pomocne również w diagnostyce:
- przewlekłego zapalenia trzustki;
- chorób wątroby;
- schorzeń ślinianek;
- niedrożności jelit;
- pęknięć wrzodów dwunastnicy;
- niektórych nowotworów, zwłaszcza raka tarczycy, raka wątroby, raka jajnika, raka jelita grubego i raka prostaty.
Warto wykonać je u alkoholików. Za normę poziomu amylazy we krwi uznaje się wynik w przedziale 25-125 U/l. Z kolei w przypadku osób starszych granice te przesuwają się do zakresu 20-160 U/l.
Polecane produkty:

|
Kolagen naturalny bioalgi
Kolagen do picia to naturalny produkt z opatentowaną formułą Peptiplus® hydrolizowanego kolagenu. Dzięki temu jest bardzo wysokiej wchłanialności. Wzmacnia zęby, kości, ... Zobacz więcej... |
Bibliografia
- Silverthorn D., Fizjologia, Wydawnictwo Lekarskie PZWL, Warszawa 2018.
- Ganong W., Fizjologia, Wydawnictwo Lekarskie PZWL, Warszawa 2008.
- Zakrzewska I., Prokopowicz J., Alfa-amylaza i jej inhibitory, Diagnostyka Laboratoryjna, 1/1979.